测定了10个具有药理意义的6h -嘧啶[2,1-a]异吲哚的理化性质。所研究的化合物为弱碱,pKa在2.38 ~ 3.46之间。进一步测定了化合物与环糊精的缔合常数。以1:1的化学计量观察了配合物的形成,发现γ-环糊精的配合效果最好。最后,研究了6h -嘧啶[2,1-a]-异吲哚在0.1 mol dm?3高氯酸钠中乙腈的电化学氧化,作为其可能的代谢降解模型。该过程为单电子过程,半波电位在1.34 ~ 1.62 V (vs. Ag/AgNO3/NaClO4)之间。采用预备电解法制备了三种化合物的电氧化产物,并用质谱法对其进行了鉴定。从获得的数据来看,很明显,6h -嘧啶[2,1-a]异吲哚的电化学氧化始于n -氧化物的形成,然后是分子的二聚化,或者与此相反,是嘧啶环的氧化裂解。从代谢的角度来看,n -氧化是与该途径相对应的过程。

含氮杂环化合物是许多具有药理活性的化合物的基础[1]。在具有良好药理活性的含氮杂环化合物中,有1961年首次合成的嘧啶异吲哚衍生物[2]。抗抑郁和厌食药物cicazindol就是这类化合物中临床应用的一个例子[3]。该化合物的结构类似物已被证明具有降糖作用[4]。为了扩大已知嘧啶吲哚的作用范围,正在合成其他衍生物;其中,嘧啶异吲哚占有重要地位。嘧啶异吲哚的合成主要由Babichev和Kovtunenko等人研究[5]。已证实嘧啶异吲哚具有利尿剂[6]、厌食剂[7]、抗艾滋病毒[8]和杀利什曼尼虫[9]的活性。然而,对这些有前景的化合物的研究仍处于早期阶段。
在这项工作中,我们重点研究了6h -嘧啶[2,1-a]异吲哚的十种衍生物(图1),这些衍生物已显示出良好的抗真菌[10]和抗疟疾[11]的作用。根据酮基的位置,所研究的化合物可分为两类:(i) 6h -嘧啶[2,1-a]异吲哚-4-酮衍生物(化合物1,3,5,7和9)和(ii) 6h -嘧啶[2,1-a]异吲哚-2-酮衍生物(化合物2,4,6,8和10)。此外,化合物5-10是环状衍生物,其中在给电子异吲哚环上添加额外的受体环段会强烈影响这些三环体系的结构和反应性,并且可以预期不同寻常的化学性质。对于这些化合物的分离,我们之前提出了非水毛细管电泳方法[12]。
图1
6h -嘧啶[2,1-a]异吲哚的化学结构研究
在第一部分的工作中,我们确定了作为基本理化参数之一的6h -嘧啶[2,1-a]异吲哚的解离常数。解离作用显著影响药物在机体内的命运,尤其是药物通过脂质膜的渗透,从而显著影响药物的药理作用。
第二部分致力于研究6h -嘧啶[2,1-a]异吲哚与环糊精的相互作用,形成基于非共价相互作用的包合物。环糊精由于其疏水空腔,可以作为药物的高效转运体,特别是那些难溶于水的药物,此外,环糊精还可以增加药物在药物制剂中的稳定性[13,14,15]。
在第三部分中,我们研究了所研究的6h -嘧啶[2,1-a]异吲哚的电化学行为,特别是它们的电化学氧化作为这些化合物在生物体中可能的生物转化的最简单模型。电化学方法是非常有用的药理学工具[16],电化学方法已被证明用于氧化药物代谢的仿生建模[17,18,19,20]。研究表明,药物的电化学氧化可以产生一种与所讨论药物的代谢物相同的化合物[21,22,23]。
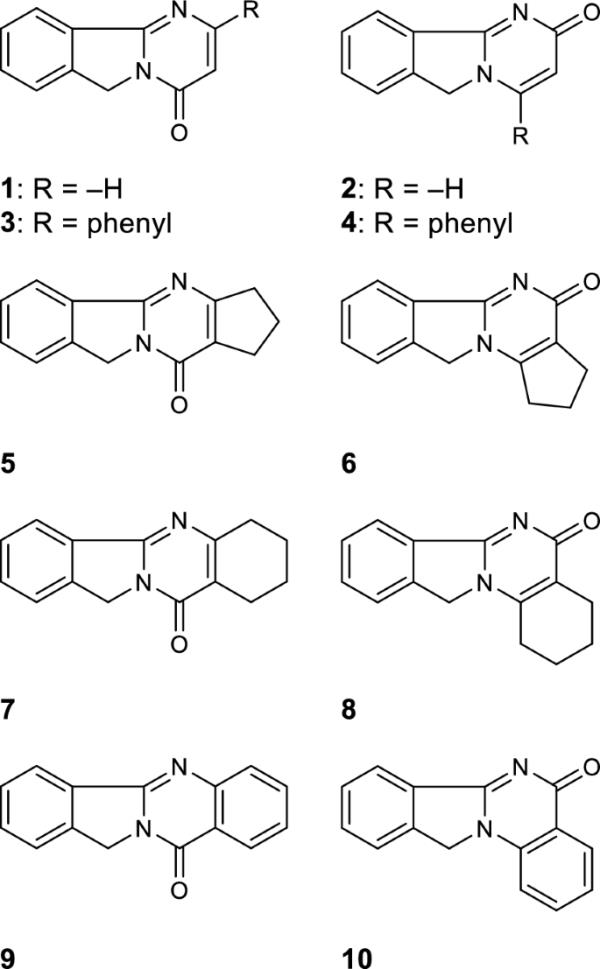
由于6h -嘧啶[2,1-a]异吲哚在水中的溶解度较低,根据Blume等[24],在水-甲醇混合环境中(所得溶液中甲醇的浓度最高为5%),用紫外-可见光谱法测定了解离常数。用醋酸或磷酸盐缓冲液保证溶液的pH值。图2显示了化合物8的光谱随介质pH值变化的例子。解离常数的测定值汇总在表1中。
图2
化合物8在不同pH介质(c(8)=2·10?5 mol dm?3,石英试管1 cm)下的吸收光谱
表1解离co6的瞬间H-pyrimido (2, 1 -一个研究了异吲哚,并利用最大吸收波长测定了它们
解离常数的测定值为2.38 ~ 3.46;当然,像大多数氮杂环一样,6h -嘧啶[2,1-a]异吲哚是弱有机碱。碱式嘧啶的解离常数为pKa=1.3[25],由于存在酮基,解离常数会升高;如3h -嘧啶-4- 1的pKa为1=1.64,pKa为2=8.6[26]。对于所研究的6h -嘧啶[2,1-a]异吲哚,2位取代基对解离常数值的影响增大,而相同的4位取代基导致解离常数值减小。效果的大小自然是由取代基的类型决定的。然而,当取代基是一个缩合环时,[c]侧缩合环的解离常数值高于[b]侧缩合环的解离常数值。
采用紫外-可见光谱法测定了所研究的6h -嘧啶[2,1-a]异吲哚的缔合常数,方法是监测不同浓度环糊精在最大吸收波长处的吸光度变化。使用Benesi-Hildebrandt方法评估化学计量学和缔合常数[27]。为了保证溶液中只存在6h -嘧啶[2,1-a]异吲哚的非质子化形式,根据解离常数的观测值,选择pH=6.8的恒定环境,也接近生理值。所研究的6h -嘧啶[2,1-a]异吲哚均与γ-环糊精形成包合物,其内腔体积最大;对于α-和β-环糊精,有些衍生物不形成配合物。6h -嘧啶[2,1-a]异吲哚:环糊精的化学计量比均为1:1。得到的关联常数值如表2所示。
表2协会公司6的瞬间H-pyrimido (2, 1 -一个用环糊精研究异吲哚(相对标准偏差小于15%)
从缔合常数的测量值可以看出,缔合常数的值取决于所使用的环糊精的类型和6h -嘧啶[2,1-a]异吲哚的空间结构。负电荷在氧原子上的分布(受酮基和取代基或环的位置影响)起主要作用。分子的平面度进一步影响缔合常数;例如,化合物7和8是最不平面的,其环形呈扭转构象。此外,环糊精的空腔可以被分子的异吲哚部分的环包裹,或者相反地,被嘧啶环上的取代基包裹。这可能解释了单个6h -嘧啶[2,1-a]异吲哚之间或相同的6h -嘧啶[2,1-a]异吲哚与不同环糊精之间的缔合常数的巨大差异。例如,化合物2和4在第4位取代基的类型不同。化合物2(4位有甲氧基)与γ-环糊精的缔合常数较大,与β-环糊精的缔合常数最小。另一方面,化合物4(4位有一个苯基)与β-环糊精的相互作用最大,与α-环糊精的作用最小。化合物7与γ-环糊精有轻微的相互作用,当α-环糊精被β-环糊精取代时,其缔合常数仅略有增加,反之亦然。
用直流伏安法在旋转圆盘电极上发现,所研究的6h -嘧啶[2,1-a]异吲哚在0.1 mol dm?3高氯酸钠的无水乙腈中一步氧化。基本电化学参数如表3所示。交换电子数的值由恒电位库仑法测定。所研究的6h -嘧啶[2,1-a]-异吲哚化合物的扩散系数是由trim Levitsch方程[28]根据ilm=f(ω1/2)的依赖关系计算得到的。
表3 6H-pyrimido (2, 1 -一个用直流伏安法在0.1 mol dm下测得的异吲哚?3 NaClO4在无水丙酮中丁腈在金旋转圆盘电极上(半波电位、对数分析伏安波的斜率、线性动态范围的校准依赖关系和回归方程的参数校准依赖关系(斜率、截距、回归系数)、交换电子数和扩散系数。其他有限公司测量条件:电极a?rea 0.111 cm2, 1226 rpm,极化速率50mv s?1,温度20℃,以Ag/0.01 mol dm为单位测量?3 AgNO3/0.1 mol dm?3 NaClO4)
从这些结果可以明显看出,化合物中末端非芳环的存在显著降低了半波电位,从而降低了氧化的能量需求(化合物5、6、7和8)。对于2位上有酮基的衍生物(化合物2、4、6、8和10),浓度曲线与6h -嘧啶[2,1-a]-异吲哚-4-酮的浓度曲线呈线性关系。这可能与化合物的结构有关;6h -嘧啶[2,1-a]异吲哚-2-酮在较高浓度下形成吸附波。交换电子的测量值为0.97 ~ 1.35;因此,很明显,所研究的6h -嘧啶[2,1-a]异吲哚的氧化是单电子过程。从扩散系数的观测值可以看出,6h -嘧啶[2,1-a]异吲哚-2- 1的扩散系数值明显低于6h -嘧啶[2,1-a]异吲哚-4- 1。这又和化合物的结构有关。由于化合物9和10中末端芳香环的存在,使得酮基位置不同的化合物的扩散系数值差异减小。
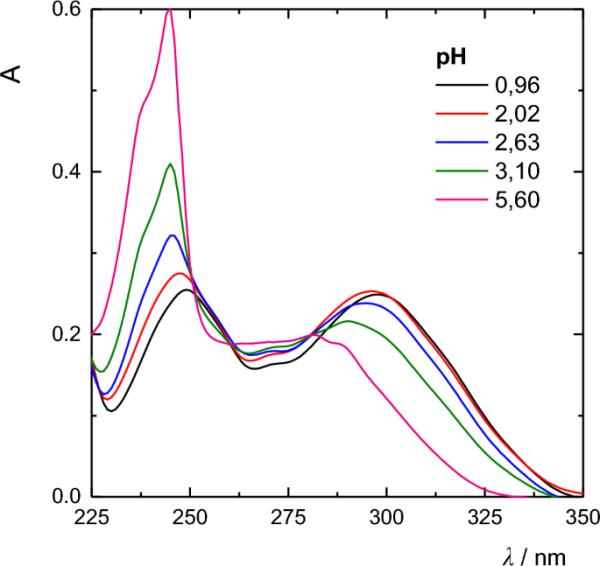
用循环伏安法测定了所研究的6h -嘧啶[2,1-a]异吲哚的电化学氧化可逆性。在0.01 ~ 15 V s?1的极化率范围内,所有化合物均有相应的阳极峰;因此,6h -嘧啶[2,1-a]异吲哚的电化学氧化是一个完全不可逆的过程(图3)。
图3
化合物3在无水乙腈中0.1 mol dm - 3 NaClO4在金圆盘电极上的循环伏安图(c=5 × 10 - 4 mol dm - 3,电极面积0.111 cm2,极化率50 mV s - 1,温度20℃,测定比为Ag/0.01 mol dm - 3 AgNO3/0.1 mol dm. - 3 NaClO4)
采用制备性电解[22,23],制备并分析了化合物1、2和5的电氧化产物。在40 cm3 0.1 mol dm?3高氯酸钠的无水乙腈中氧化10 mg化合物,电位对应于极限扩散电流,即化合物1在1.90 V,化合物2在1.82 V,化合物5在1.60 V。电解时间为2h。
化合物5电解后的独立溶液中有缓慢的黄色沉淀物沉淀,因此电解后立即用干冰冷冻保存。通过质谱分析,发现1h -异吲哚-1,3 (2H)-二酮(图4,化合物11)是化合物1和2的电化学氧化产物。化合物5电解得到两种产物,即n -氧化物(图4,化合物12和13)。黄色沉淀物被鉴定为二酮(图4,化合物14)。
图4
鉴定的6h -嘧啶-[2,1-a]异吲哚的电化学氧化产物:1h -异吲哚-1,3(2H)-二酮(11)、环penta[b] 6h -嘧啶[2,1-a]异吲哚-4- 1- 1- n -氧化物(12)、环penta-3-on[b] 6h -嘧啶[2,1-a]异吲哚-4- 1- n -氧化物(13)、双(环penta[b] 6h -嘧啶[2,1-a]异吲哚-4-one) (14)
根据得到的结果,可以假设所研究的6h -嘧啶[2,1-a]异吲哚的电化学氧化过程如下。对于任何化合物,电化学氧化都是从氮原子1位上的一个电子的消除开始的,产生的自由基只有很短的寿命。这种自由基要么发生二聚化反应(表现为电解后溶液中形成黄色沉淀物),这是氮杂环氧化中非常常见的反应途径,要么与反应介质中存在的微量水发生反应,形成n -氧化物。在没有侧环的衍生物(化合物1-4)的情况下,嘧啶环发生氧化裂解形成离子。末端环的存在可能对产生的n -氧化物有稳定作用,并防止嘧啶环的氧化裂解。
这一提出的机制与已知的电化学、化学和/或生物氧化嘧啶衍生物的数据一致。在文献中,相应的n -氧化物被描述为吲哚[29]或异吲哚[30]的电化学氧化产物。Jennings等人[31]报道了多种5-取代吲哚单体的电化学氧化可形成各种二聚体、三聚体和聚合物。n-氧化物的形成也是各种杂环含氮化合物化学氧化的典型过程[32,33]。氮杂环化合物的生物氧化也以细胞微粒体系统催化的所谓n氧化为特征[34]。在生物转化的第二阶段,n -氧化物进一步与n -葡萄糖醛酸盐结合[35],或者在生成二酮的情况下形成o -葡萄糖醛酸盐[36]。在研究的6h -嘧啶[2,1-a]-异吲哚的前体,临床使用的环齐吲哚[37]中也观察到嘧啶环的氧化裂解。同样,在先前的n -去乙基化和n -氧化后,观察到丙硫脲的吲哚环被切割[38]。
摘要
介绍
结果与讨论
结论
实验
数据可用性
参考文献
致谢
作者信息
搜索
导航
#####
本文第一部分测定了弱有机碱6h -嘧啶[2,1-a]异吲哚的解离常数。解离常数的大小主要取决于酮基的位置和取代基的结构。在第二部分的工作中,测定了6h -嘧啶[2,1-a]-异吲哚与环糊精形成的化学计量比为1:1的配合物的缔合常数值。此外,在这种情况下,缔合常数的值受到特定化合物结构的影响。研究了6h -嘧啶[2,1-a]异吲哚在非水介质中阳极氧化的基本电化学参数。电化学氧化也被成功地用作I相生物转化的简单模型。由于6h -嘧啶[2,1-a]异吲哚尚未在体内进行检测,因此获得的结果为其可能的代谢命运提供了有益的线索。
所研究的6h -嘧啶[2,1-a]异吲哚是根据Ishchenko等[39]制备的。通过元素分析、熔点测定、薄层色谱、红外光谱和核磁共振等方法确定了物质的性质和纯度。用浓度为5 × 10?3 mol dm?3的甲醇配制用于测定解离和缔合常数的化合物原液。所有其他使用的化学物质都是p.a.或更高质量的:醋酸99% (Lach-Ner,捷克共和国)、乙腈(Aigma-Aldrich)、α-环糊精(Sigma-Aldrich)、β-环糊精(Sigma-Aldrich)、γ-环糊精(Sigma-Aldrich)、盐酸35% (Lach-Ner,捷克共和国)、甲醇(Merck)、磷酸85% (Lachema,捷克共和国)、磷酸二氢钾(Lach-Ner,捷克共和国)、硝酸银(Lach-Ner,捷克共和国)、磷酸二氢钠(Lach-Ner,捷克共和国)、氢氧化钠(Lach-Ner,捷克共和国)、高氯酸钠(Sigma-Aldrich)
采用Agilent 8453紫外可见光谱系统光谱仪测量吸收光谱。测量在有1.00 cm吸收层的石英试管中进行。pH测量是在Jenway 3305 pH计与组合玻璃电极上进行的。三点式玻璃电极在pH=4.01±0.01、7.01±0.01和10.01±0.01下进行校准(HANNA Instruments, USA)。由于无机盐(用于制备缓冲液)的存在可以促进与环糊精的聚集,因此在测量缔合常数时,可以通过加入适量的0.1 mol dm?3 HCl或0.1 mol dm?3 NaOH来调节溶液的pH[14]。直流和循环比色测量在Eko-Tribo极谱仪(Polaro-Sensors,捷克共和国)上进行[22,23]。采用活性表面积为0.111 cm2的铂盘电极。参考电极是银板,浸入0.01 mol dm?3 AgNO3和1.00 mol dm?3 NaClO4的乙腈溶液中,通过填充0.5 mol dm?3 NaClO4的乙腈盐桥与被测溶液分离。铂棒用作对电极。我们以前的工作[40]描述了恒电位库仑法。制备电解的细节发表在我们之前的作品中[22,23]。制备电解制得的产物采用与Finnigan MAT INCOS 50质谱联用的Varian 3400气相色谱仪进行分离。分离采用db5色谱柱(直径30 m × 0.25 mm;膜厚0.012 μm),温度250℃。采用电子冲击电离法。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00706-023-03075-2.pdf




