尽管微卫星不稳定转移性结直肠癌(CRC)患者受益于免疫检查点阻断,但靶向治疗化疗仍然是微卫星稳定(MSS)肿瘤的唯一治疗选择。这项单臂1b/2期MEDITREME试验评估了durvalumab + tremelimumab联合mFOLFOX6化疗在一线治疗的安全性和有效性,共57例ras突变不可切除转移性结直肠癌患者。安全性是Ib期的主要目标;没有发现安全问题。MSS肿瘤患者3个月无进展生存期(PFS)的2期主要疗效目标得到满足,3个月PFS为90.7%(95%置信区间(CI): 79.2-96%)。二级目标有效率为64.5%;中位PFS为8.2个月(95% CI: 5.9-8.6);MSS肿瘤患者的总生存期未达到。我们观察到应答者较高的肿瘤突变负担和较低的基因组不稳定性。综合转录组学分析强调,高免疫特征和低上皮-间质转化与更好的结果相关。免疫监测显示,诱导新抗原和NY-ESO1和TERT血液肿瘤特异性T细胞反应与较好的PFS相关。durvalumab-tremelimumab联合mFOLFOX6在MSS mCRC中是可耐受的,具有良好的临床活性。Clinicaltrials.gov识别码:NCT03202758。
转移性结直肠癌(CRC)的治疗主要依赖于化疗,当转移不能切除时,通常用于姑息目的。随着化疗和靶向治疗的改善,结直肠癌的中位总生存期(OS)一直在上升1,2,3,4,5,6。结直肠癌是一种异质性疾病,根据其遗传特征分类,指导预后和治疗7,8,9。结直肠癌的一个特殊遗传亚群是具有微卫星不稳定性(MSI)的肿瘤,导致高肿瘤突变负担(TMB)和大免疫浸润10。对于这类肿瘤,使用靶向PD-1/PD-L1的单克隆抗体进行免疫治疗已证明有效11。对于其他类型的CRC,称为微卫星稳定型(MSS),免疫治疗与单药治疗一样无效。
许多研究强调免疫系统识别CRC,高CD8 T细胞浸润与局部或转移性crc更好的预后相关13,14。临床前数据表明,PD-1/PD-L1抑制剂与免疫原性细胞死亡诱导剂(如奥沙利铂)联合使用可提高免疫治疗效果15,16,17。5-氟尿嘧啶(5-FU)可以消除髓源性抑制细胞,限制肿瘤诱导的免疫抑制18,19。因此,5-FU联合奥沙利铂可提高抗肿瘤免疫反应。在小鼠CRC模型中,抗pd - l1 + FOLFOX组合可观察到协同效应20。基于这些数据,我们设计了1b/2期MEDITREME试验(NCT03202758)。在这篇文章中,患者接受3个月的改良mFOLFOX6方案(6个周期)联合durvalumab和tremelimumab作为诱导治疗,然后使用durvalumab维持治疗直到病情进展。目的是探讨MSS mCRC的可行性和有效性,并探讨其基因组和免疫学特征。为了获得均匀的缓解率和无进展生存期(PFS),我们重点研究了ras突变肿瘤患者。
总体而言,2017年8月30日至2019年12月20日期间,来自8家法国医院的57例不可切除的转移性ras突变CRC患者被纳入研究(扩展数据图1a,b)。患者在第1天接受6个周期(3个月)静脉注射mFOLFOX6(奥沙利铂(85 mg m?2)和叶酸(200 mg m?2),随后静脉注射5-FU (400 mg m?2),然后静脉注射5-FU (2400 mg m?2),之前是durvalumab (750 mg每2周)和tremelimumab (75 mg每4周)。同时治疗后肿瘤稳定或有反应的患者继续维持杜伐单抗(750 mg / 2周),自首次研究治疗以来最多持续1年。第一部分是Ib期研究,纳入了9例患者。进行了协议定义的安全性审查。在没有任何安全事件警告的情况下,另外48名患者被纳入2期研究。中位年龄63.6岁(范围28-80岁);女性33例(58%);17例(30%)患者为左侧结直肠癌;13例(23%)患者患有直肠癌;45例(79%)患者出现肝转移;23例(40%)患者出现肺转移;17例(30%)患者发生腹膜转移。10例(17.5%)患者接受mFOLFOX6作为辅助治疗。10例(17.5%)患者患有异时性疾病(扩展数据表1)。
56例(98%)患者发生了不良事件(ae)(扩展数据表2)。38例(67%)患者发生了与治疗相关的3/4级ae,导致7例(12%)患者(2例糖尿病、2例垂体炎、2例输液反应和1例脑炎)停止治疗。未发生5级ae。毒性反应主要与化疗有关,32例(56%)患者出现与化疗相关的3级和4级毒性反应,8例(14%)患者出现与免疫治疗相关的毒性反应。对于化疗相关的毒性,最常见的事件是34例(60%)患者腹泻,28例(49%)患者中性粒细胞减少和20例(35%)患者血小板减少。对于免疫治疗相关的毒性,最常见的事件是21例(37%)患者的皮肤反应,15例(26%)患者的内分泌病变,3例(5%)患者的结肠炎和肝炎。值得注意的是,90%的3/4级ae发生在化疗免疫治疗期间。
57例患者中,51例已知MSS状态;3人具有MSI状态;48人具有MSS身份。根据方案,只有48例MSS肿瘤患者被纳入疗效分析的合格人群。中位随访时间为36个月(2.5-33.9)。2期的主要目标得到满足,3个月的PFS为90.7%(95%置信区间(CI): 79.2-96%)。6个月、12个月和24个月的PFS分别为60.4% (95% CI: 45.2-72.6%)、26.9% (95% CI: 15.3-39.9%)和6.7% (95% CI: 1.8 - 16.5%)。关于次要目标,中位PFS为8.2个月(95% CI: 5.9-8.6)(图1a)。6个月、12个月和24个月的OS分别为95.8% (95% CI: 84.3-98.9%)、81.1% (95% CI: 67.8 - 89.7%)和57.6% (95% CI: 42.3-70.2%)。中位OS未达到(图1b)。31例(64.5%)患者达到实体瘤应答评价标准(RECIST)客观应答;25例(52%)患者部分缓解;6例(12.5%)患者达到完全缓解。疾病控制率(完全缓解+部分缓解+病情稳定)为93.7%。
图1:患者临床特征。
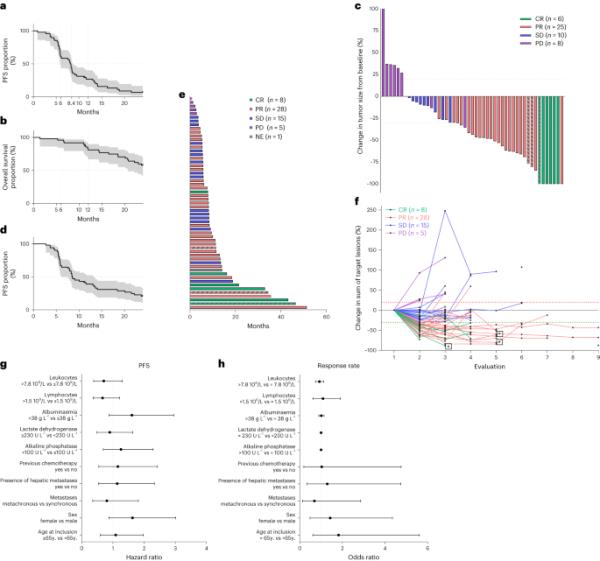
a,b,中位DOR的MSS肿瘤患者PFS (a)和OS (b)的Kaplan-Meier曲线(n=48)。c,整个队列目标病变肿瘤大小的瀑布图(n=57),根据RECIST根据肿瘤从基线缩小的最大百分比着色。MSI肿瘤患者(n=3)用虚线表示。d,中位DOR的MSS肿瘤患者(n=48) DOR的Kaplan-Meier曲线。e,整个队列PFS时间的Swimmer图(n=57),根据RECIST着色。条形图的长度表示从随机化到疾病进展的时间。RECIST不能对单个患者进行评估。MSI肿瘤患者(n=3)用虚线表示。不,non-evaluable。f,蜘蛛图显示根据整个种群的评估次数,与基线相比直径总和的变化百分比(n=57)。每条线对应一个病人,并根据RECIST的颜色。MSI肿瘤患者用星形识别。g, MSS队列中临床变量与PFS相关性的总体HR估计值的森林图表示,95% ci (n=48)。圆形符号表示点估计,胡须表示95% CI。垂直虚线表示与参考水平相比没有变化(比率为1)。h,森林图表示MSS队列中临床变量与客观缓解率之间的比值比估计值,95% ci (n=48)。圆形符号表示点估计,胡须表示95% CI。垂直虚线表示与参考水平相比没有变化(比率为1)。双侧P值,显著性水平为0.05。对于每条Kaplan-Meier曲线,sd区间用灰色标记。
源数据
在整个人群中,存活于6个月、12个月和24个月的患者估计百分比分别为96.5% (95% CI: 86.7-99.1%)、80.6% (95% CI: 67.6-88.8%)和59.1% (95% CI: 45.1-70.6 -%)。6个月、12个月和24个月PFS患者的估计百分比分别为63.2% (95% CI: 49.3-74.2%)、38.5% (95% CI: 26-50.9%)和19.9%(10.6-31.3%)。所有患者的最佳反应在瀑布图中显示(图1c)。中位治疗时间为5.4个月(0.9-12个月)。Kaplan-Meier图、游泳者图和蜘蛛图显示了反应持续时间(DOR)(图1d-f)。中位DOR为8.5个月(95% CI: 6.2-13.4), 28%的患者在12个月时仍在使用durvalumab, 61%的患者在6个月时仅接受了3个月的化疗。5例患者在研究人员决定的进展时重新引入FOLFOX durvalumab和tremelimumab, 3例患者在数据库关闭时仍有应答。在分析时,2例患者仍在接受治疗;34例患者因疾病进展而终止研究;13例患者因其他原因停止治疗,因此复发;8例患者完全缓解,无复发。
在一个非预先确定的亚组中,我们分析了临床预后变量。经典预后变量在缓解率或PFS方面无显著差异(图1g,h)。
对所有患者进行体细胞面板以确认NRAS、KRAS和BRAF突变和MSI状态。37例患者进行外显子组测序。最常见的突变是APC、KRAS和TP53(图2a)。没有超过10%的患者发生与PFS相关的基因改变(图2a)。所有患者的TMB中位数为每兆碱基6.1个突变(Mb),并且根据肿瘤的侧边性没有差异(扩展数据图2a)。3例TMB每Mb突变数超过10个;TMB > 5.8与PFS较长相关(风险比(HR)=0.41, 95% CI: 0.18-0.90, P=0.02)(图2b)。当我们评估与推定免疫原性I类新抗原相关的非同意序列改变时(使用pVACtools21),我们发现低数量的新抗原(<14)与更好的PFS相关(HR=2.35, 95% CI: 1.04-5.30, P=0.04)(图2c)。人类白细胞抗原(HLA) I类位点的最大种系理化序列差异与PFS或客观反应率无关(图2d,e)。尽管HLA分化与结果无关,但HLA- b和HLA- dob mRNA的高表达与更好的应答率相关,这表明T细胞抗原呈递能力越强,治疗效果越好(扩展数据图2b)。肿瘤基因组改变的特征是克隆性、倍性、杂合性丧失和大的染色体缺失。使用同源重组缺陷(HRD)评分来估计基因组结构改变,这是一种测量基因组不稳定性的方法22;低HRD评分(<29)与较好的PFS相关(图2f)。
图2:患者基因组特征。
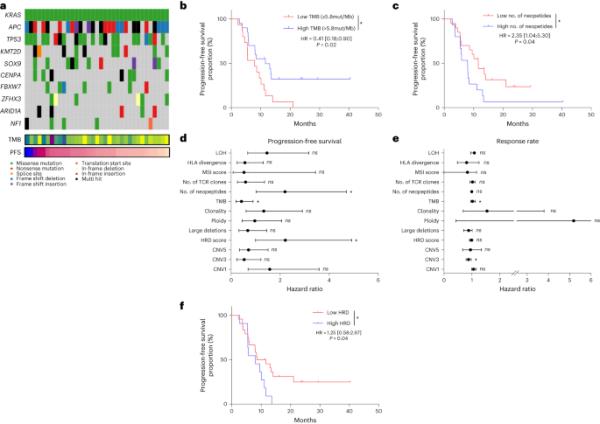
A,代表在队列中最常观察到的基因的基因组景观的肿瘤图。TMB和PFS时间也显示在底部。b,根据TMB分层的PFS患者的Kaplan-Meier曲线,截止值为每Mb 5.8个突变(n=35)。双侧P值,显著性水平为0.05。c, Kaplan-Meier曲线为PFS患者的Kaplan-Meier曲线,根据新肽的数量进行分层,中位数为截止值(n=35)。双侧P值,显著性水平为0.05。d,全外显子组衍生变量与PFS相关性的总体HR估计的95% ci的森林图表示。e,全外显子组衍生变量与客观反应率相关性的比值比估计值95% ci的森林图表示。圆形符号表示点估计,胡须表示95% CI (n=35例患者(d,e))。垂直虚线表示与参考水平相比没有变化(比率为1)。f,根据HRD评分对PFS患者进行分层的Kaplan-Meier曲线(n=35)。双侧P值,显著性水平为0.05。生存分布比较采用log-rank检验(b,c,f)。采用单因素Cox比例风险模型来估计HR和95% CI (d,e)。*P < 0.05,采用双侧Wald检验(d,e)。mut/Mb,每兆碱基突变数。
源数据
我们分析了来自癌症基因组图谱(TCGA)的341例CRC肿瘤的独立队列的肿瘤全外显子组测序数据,该数据早于免疫检查点阻断时代。在TCGA队列中,TMB与PFS或OS无关。HRD评分与较短的PFS和OS相关,而大量的新肽与较短的PFS相关(扩展数据图2c)。总之,这些结果支持,尽管TMB似乎是一个预测标记,但其他基因组标记更多的是预测而不是预测。
对36例患者进行RNA测序(RNA-seq)分析。中位PFS与单个蛋白编码基因表达之间的关系采用差异基因分析。使用ssGSEA, EMT签名、IL6/JAK/STAT3签名和CAF签名与较短的PFS呈边缘关系,而免疫签名与较长的PFS相关(图3a)。我们比较了完全缓解者和其他患者的转录组谱。在显著富集的基因上使用KEGG通路2021,应答者中只有免疫相关通路(趋化因子信号通路、细胞因子-细胞因子受体相互作用)显著富集(图3b)。使用MCP-counter23、ImmuCellAI24和Kassandra25软件描述基线免疫浸润。所有软件程序均显示T细胞浸润与PFS延长之间存在显著或边缘性关联(图3c-e)。Durvalumab靶向PD-1与PD-L1之间的相互作用,tremelimumab靶向CTLA-4与CD80/CD86之间的相互作用。我们检测了PD-L1 (CD274)、PD1 (PDCD1)、CTLA-4、CD80和CD86的表达与PFS的关系。对于每个变量,采用最大选择秩统计方法选取最佳截止点,将患者分为高分组和低分组。使用这种策略,我们观察到只有高CTLA-4 mRNA表达与更好的PFS相关(图3a,f)。
图3:Trans患者的密码组特征。
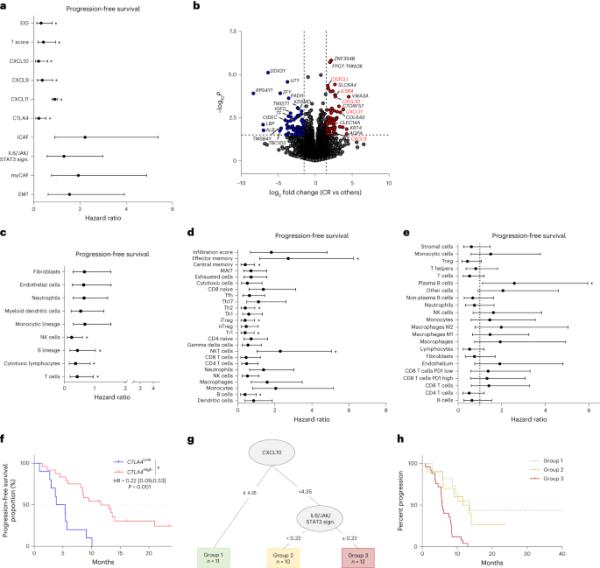
a,总体HR估计值的Forest图,95% CIs显示了与EMT和T细胞浸润相关的选定rna -seq衍生特征与PFS的关联(n=32)。b, Volcano图描述了对完全应答者和其他患者的RNA-seq数据进行的差异分析。log2 FC表示每个基因的平均表达量。每个点代表一个基因。c, MCP-counter衍生的免疫细胞群与PFS相关性的总体HR估计值的森林图,95% ci (n=32)。d, ImmuCellAI衍生的免疫细胞群与PFS相关性的总体HR估计的森林图(95% ci) (n=32)。e, Kassandra衍生免疫细胞群与PFS相关性的总体HR估计值(95% ci)的森林图(n=32)。圆形符号表示点估计,胡须表示95% CI (a, c-e)。垂直虚线表示与参考水平相比没有变化(比率为1)。*P < 0.05, log-rank检验(a, c-e)。f,根据CTLA4基因表达水平分层的PFS患者的Kaplan-Meier曲线,中位数为截止点。双侧P值,显著性水平为0.05。g,用基质和免疫相关参数估计PFS的决策树。h, Kaplan-Meier曲线,根据PFS决策树创建的组对患者进行分层。双侧P值,显著性水平为0.05。采用log-rank检验(f-h)比较生存分布。MAIT,粘膜相关不变量T。
源数据
为了进一步探讨基质和免疫成分各自的作用,我们使用决策树分析了与PFS相关的所有免疫和基质特征,单变量分析的P < 0.1。低CXCL10和高IL6/JAK/STAT3特征表达是预测预后的最重要变量(图3g,h)。
总之,这些数据强调了富含免疫细胞、T细胞趋化因子和低基质特征的TME是对化学免疫治疗有更好反应的预测因素。
PD-L1 CPS表达与预后无关(扩展数据图3a-d)。肿瘤核心的高CD8浸润与较好的PFS相关,浸润边缘的高CD8浸润与较好的应答率相关,但与较好的PFS无关(图4a-c)。肿瘤核心的PD-L1 h -评分和CD8数量可预测PFS。PD-L1 h -评分低、PD-L1 h -评分高、肿瘤核心CD8高浸润的患者PFS较其他患者更长(图4d,e)。我们检测了decorin的表达,decorin是炎症性癌症相关成纤维细胞(iCAFs)中高度表达的细胞外基质成分26。我们观察到低decorin患者的PFS更长(图4f,g)。结合CD8和decorin的信息,我们观察到高CD8和低decorin的患者PFS更长(图4小时)。通过对7名应答者和5名无应答者的成像细胞计数,我们观察到,应答者在CD3+细胞中富集,而无应答者在间质室中具有高的1型胶原(COL1)含量。CD3+与COL1表达的比值可预测客观反应,是客观反应的一个有价值的指标。在无应答者中,COL1似乎代表了癌细胞和免疫细胞之间的保护屏障(扩展数据图3e,f)。
图4:免疫学探索性分析。
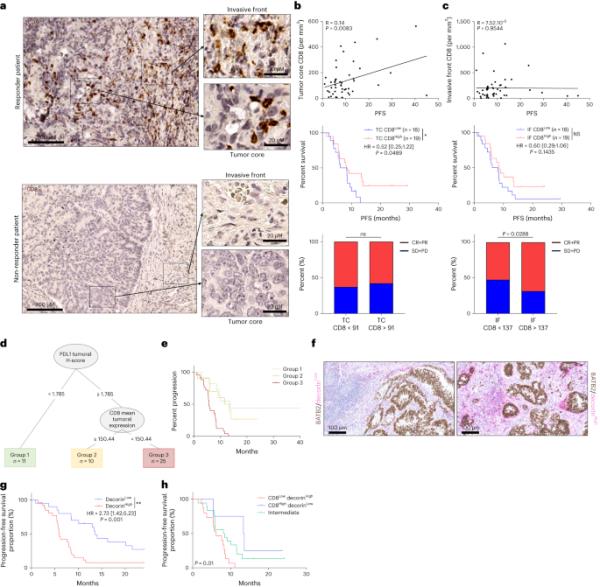
a,有应答者和无应答者CRC样本CD8染色的代表性图片(标尺,100μm),聚焦于浸润性(IF)前部区域和肿瘤核心(TC)区域(标尺,20μm)。b,c, TC (b)和IF (c)中CD8+细胞的分析。上图为TC(分别为浸润边缘)每mm3 CD8数量与PFS的相关性。相关性采用Spearman检验。中图为PFS患者的Kaplan-Meier曲线,根据TC(分别为浸润边缘)的CD8高或低水平进行分层。以总中位数作为区分两组的阈值。双侧P值,显著性水平为0.05。下图,条形图显示根据肿瘤核心(分别为浸润边缘)CD8的数量,完全缓解和部分缓解(CR + PR)或稳定疾病和进展疾病(SD + PD)的百分比(n=37)。NS,不显著;*P < 0.05,采用Fisher精确检验比较。d,用免疫组织化学变量估计PFS的决策树。e, Kaplan-Meier曲线,根据PFS决策树创建的组对患者进行分层。双侧P值,显著性水平为0.05。f, decorin低表达患者(左)和decorin高表达患者(右)CRC样本的decorin/SATB2染色代表性图片(标尺,100μm)。g,h,根据decorin蛋白表达水平(g)和CD8与decorin蛋白表达水平(h)联合分层的PFS患者Kaplan-Meier曲线(n=47)。双侧P值,显著性水平为0.05。生存分布比较采用log-rank检验(e,g,h)。
源数据
使用bioplex法检测44种不同的细胞因子(补充文件表1),我们注意到,与对照组相比,转移性结直肠癌血浆中有17种细胞因子高度存在(扩展数据图4a)。只有高干扰素(IFN)-β基线产生与更好的应答率相关(扩展数据图4b)。在治疗期间,我们观察到可溶性PD-L1水平升高,尽管与结果无关(扩展数据图4c-f)。在一个治疗周期(C2)后,高水平的白细胞介素(IL)-6和IL-8与较差的缓解率(扩展数据图4,h)和较短的PFS(扩展数据图4,j)相关。
为了了解治疗的全身免疫效应,我们在基线、第2周期和第5周期检测了57例患者的外周血单核细胞(PBMCs)(补充文件表2和补充文件图1-6);我们共区分出36种免疫细胞类型(补充文件图7)。在基线时,只有高水平的Foxp3?CD4+CD25+和Th1 PD1lowCD28+中枢记忆细胞与更好的PFS相关(扩展数据图5a-c)。单核细胞髓源性抑制细胞(mmdsc)不受治疗影响,而粒细胞MDSCs (gmdsc)在C2和C5时减少(扩展数据图5d,e)。高水平的mmdsc而非gmdsc与低应答率相关(扩展数据图5f,g)。mmdsc和gmdsc均与PFS无关(扩展数据图5h,i)。治疗期间MDSC水平降低与缓解率或PFS均无关联(扩展数据图5j,k)。
使用ELISpot,我们研究了抗肿瘤特异性T细胞对血液中共享肿瘤抗原、端粒酶和NY-ESO1的反应。我们观察到37.5%的患者对这两种抗原中的至少一种表现出基线T细胞应答(图5a)。一个治疗周期后,针对任一抗原的T细胞应答增加,46.7%的患者检测到T细胞应答(图5a)。对这些抗原的基线反应与客观反应或PFS无关(扩展数据图6a-f)。相比之下,在C2和C5发现的T细胞对端粒酶的反应与数字上但非统计学上显著更好的客观反应和显着更长的PFS相关(图5b,c,e,f)。同样,诱导T细胞对C5发现的NY-ESO1抗原的反应与更好的反应率相关(图5d)。T细胞对端粒酶和NY-ESO-1反应的综合分析显示,至少在C2或C5处存在一种反应性与更长的PFS显著相关(图5g,h)。这些数据支持基线免疫浸润的存在和对共享肿瘤抗原的免疫反应的诱导与治疗反应相关。
图5:免疫学探索性分析。
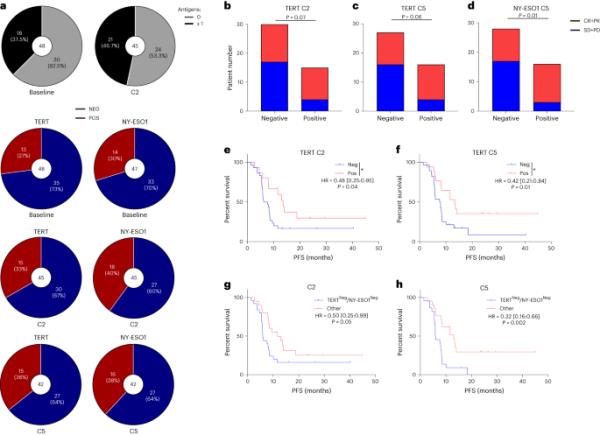
a,上面板,整体的部分(黑色和灰色)显示了患者在基线(n=40)和C2 (n=45)时对零或至少一种抗原的抗肿瘤反应的分布。下图,整体部分(红色和蓝色)显示基线(n=48), C2 (n=45)和C5 (n=42)时对TERT或NY-ESO1抗肿瘤反应阳性(红色)或阴性(蓝色)的百分比。b - d,条形图显示根据tert特异性T细胞反应在C2 (b), C5 (c)和ny - eso1特异性T细胞反应在C5 (d)的完全缓解和部分缓解(CR + PR)或疾病稳定和疾病进展(SD + PD)的数量。双侧P值,显著性水平设置为0.05,使用Fisher精确检验进行比较。e,f,根据tert特异性T细胞反应在C2 (e)和C5 (f) (n=45)对PFS患者进行分层的Kaplan-Meier曲线。双侧P值,显著性水平为0.05。g,h根据在C2 (g)和C5 (h)时TERT和ny - eso1特异性T细胞反应的组合进行分层的PFS患者的Kaplan-Meier曲线(n=45)。双侧P值,显著性水平为0.05。采用log-rank检验(e-h)比较生存分布。* p < 0.05。否定、消极;POS、积极。
源数据
在部分缓解的患者中,使用单细胞RNA测序(scRNA-seq)和T细胞受体(TCR)测序对一名切除剩余肝转移灶的患者进行监测。分别在基线、1个月和肝手术时服用pbmc。从肝转移瘤中分离出肿瘤浸润淋巴细胞(til)(扩展数据图7a)。患者被诊断为同步性直肠癌,伴有3个肝转移和主动脉周围淋巴结。患者接受了6个月的治疗。主动脉周围淋巴结和1例肝转移消失(扩展数据图7b)。我们在剩下的两个肝转移灶中观察到部分缓解。病人接受了手术。组织学显示完全坏死,没有剩余的活肿瘤细胞(扩展数据图7c)。经过3年多的随访,患者未复发。与基线活检相比,我们观察到肿瘤坏死周围有大量CD8 T细胞和PD-L1+巨噬细胞积聚(扩展数据图7d)。使用scRNA-seq,我们分析了血液和TIL CD8 T细胞亚群。经过质量控制,我们获得了935个T细胞的scRNA-seq图谱,其中包含262对TCR序列(补充文件表3)。使用无监督图聚类,我们观察到9个CD8 T细胞簇(扩展数据图8a-d)。血液和肿瘤的分布是不均匀的。在肿瘤中,我们观察到一群高表达效应细胞因子和细胞毒性分子的多功能CD8 T细胞的积累。相反,在血液中,我们观察到幼稚T细胞的积累。在治疗过程中,肝脏手术时1个月时观察到中枢记忆细胞的积累,6个月后观察到耗尽的T细胞的积累,提示免疫反应的衰竭(图6a)。与血液样本(4-50)相比,大多数克隆T细胞分布在til中(167)。所有样本中只有两个克隆存在(图6b)。基线血样和TILs共有2个克隆。相比之下,手术时TILs和血液之间共有12个克隆型,这表明这些克隆是在治疗期间诱导的(图6b)。我们使用GLIPH软件27,该软件将共享CDR3基序的类似tcr聚集在一起,预测它们会结合相同的主要组织相容性复合体(MHC)限制性肽抗原。在7个最常见的集群中,只有3个汇集了不同的T细胞克隆(从3个到13个)(补充文件表4)。这些克隆仅在TILs和肝脏手术时的血液中检测到,并且主要是多功能和耗尽的(图6c)。聚类偏好分析强调了多功能T细胞克隆中TILs的富集(图6d)。这些数据支持诱导PBMCs和TILs抗肿瘤免疫应答的基本原理,其诱导肿瘤特异性克隆在TILs中具有多功能表型,而在PBMCs中具有耗尽表型。
图6:原位肿瘤特异性CD8反应分析呼叫急救人员。
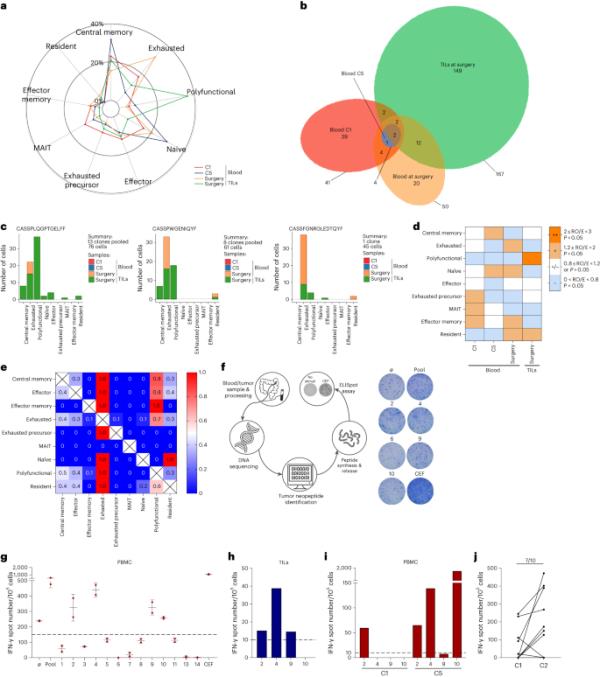
a, Radar图显示了在C1、C5和手术时血液和TILs手术时采样的T细胞簇的比例。b,维恩图显示给定采样原点的TCR克隆型分布。c,条形图显示了三个最常见的TCR集群中每个T细胞群体在给定采样来源的情况下观察到的细胞数量的分布,d, RO/E指数估计的每个集群的样本偏好;++(2≤RO/E < 3, P < 0.05)表示富集;+(1.2≤RO/E < 2, P < 0.05)为轻度富集;+ /?(0.8≤RO / E < 1.2,或P > 0.05)代表非重要;和?(0 < RO / E < 0.8, P < 0.05)代表删除。e,热图显示属于主要表型集群(行)的克隆型T细胞的比例,这些克隆型与其他次要表型集群(列)共享。f,左图为该应答者患者特异性T反应分析解释图。从血液和肿瘤样本中,进行外显子组测序,并使用生物信息学分析,鉴定出仅在肿瘤中发现的新肽。合成这些肽,并利用血液和肿瘤样本检测对这些肽的特异性T反应,以分析特异性抗肿瘤反应的出现。右图为肝手术时使用pbmc进行体外IFN-γ ELISpot的代表性图片。g,点阵图表示肝脏手术时pbmc中每种情况(阴性对照、肽池、单肽1-14和阳性对照(CEF池))的IFN-γ点数量。每个数字对应于测试的新抗原。?,二甲基亚砜;CEF,来自巨细胞病毒的肽。爱泼斯坦-巴尔病毒和流感病毒和池对应于测试的新抗原池。点表示技术复制。数据为平均值±s.d. h,i,柱状图表示肝转移TILs中肽2,4,9和10的IFN-γ点的数量(i),以及基线时(C1)和四个化疗周期后(C5) (j)。j,点图表示基线时或两个化疗周期后(C2)收集的患者pbmc中IFN-γ点的数量计算肿瘤新抗原池刺激(n=10)。MAIT,粘膜相关不变量T。
源数据
然后我们研究了克隆状态的转变。耗尽型和多功能性表型共享不同的簇(图6e),这表明TME中的这种簇通常经历广泛的状态转换。为了确认过渡状态,使用Monocle(2.12.0版本)将细胞排序到分支伪时间轨迹中。TILs中CD8 T细胞的伪时间排序表明,中枢记忆细胞向常驻T细胞或耗尽T细胞发散,而多功能细胞则代表中间状态(扩展数据图8e-i)。这些结果支持了治疗开始后在肿瘤部位发现的克隆T细胞是具有干性能力和低耗竭特征的中间细胞,容易引发抗肿瘤免疫反应的基本原理。
利用肿瘤的外显子组测序,我们检测到28个非同义突变。使用pVAC-Seq软件,我们预测了14种强HLA结合新抗原(图6f和补充文件表5)。使用ELISpot,我们检测了肝脏手术时采集的血液CD8是否能对每种新肽产生反应(图6f,g)。我们观察了AP2-γ、Trim-17、Jip-4和Mucin-4蛋白中存在的四种新肽的反应性(图6g)。在TILs中发现了对三种新肽的显著反应性(图6小时)。在血液中,我们观察到基线时仅对这四种新肽中的一种有反应,但治疗1个月后对三种新肽有反应(图6i)。我们能够在10名患者身上测试外周免疫对肿瘤来源的新肽的反应。在基线和C2时收集的pbmc被新肽刺激(1至8个取决于患者;补充文件表6)。10例患者中有7例在C2处使用新肽后免疫应答增强(图6j)。这些结果表明,化学免疫治疗方案可以扩增和产生新抗原特异性CD8 T细胞免疫反应,这种免疫反应可以在血液或肿瘤中检测到。
摘要
主要
结果
讨论
方法
数据可用性
参考文献
致谢
作者信息
道德声明
同行评审
扩展数据
补充信息
源数据
搜索
导航
#####
这项研究报告了一线化学免疫治疗对ras突变转移性结直肠癌的临床和生物学反应。该研究达到了其主要目标,3个月的PFS为90.7%,6个月的PFS为60%,中位PFS为8.2个月,而单独使用FOLFOX的此类人群的预期中位PFS为5-6个月。该方案产生的结果与贝伐单抗双重化疗观察到的结果相似,后者给予约8个月的PFS28。在转移性结直肠癌临床试验中,PFS方面的不同结果必须通过几个考虑因素来减轻。首先,上面描述的大多数研究包括野生型(WT)和RAS突变的患者,与RAS WT患者相比,RAS突变的转移性CRC预后较差(中位生存期为28个月),RAS WT患者的中位生存期约为33个月29,30。在最近的一项比较FOLFOX和FOLFOX-贝伐单抗仅用于kras突变患者的试验中,FOLFOX组的PFS仅为5.6个月31。
在应答率方面,我们的研究报告了63%的客观应答率,相比之下,用FOLFOX单药治疗的突变RAS肿瘤的客观应答率为36%(成为研究)。我们的试验产生了迄今为止文献中双化疗治疗的最佳客观反应率之一32(补充文件图8)。此外,MEDITREME试验的反应率与用folfoxii -贝伐单抗治疗RAS突变肿瘤的反应率相似,后者的客观反应率为65%28,这表明化疗强化可能产生与我们的化学免疫治疗方案相似的反应。另一个特点是,15%的患者在这种治疗后持久完全缓解,而使用folfirinox -bevacizumab的患者只有5%。这表明,与化疗方案相反,化疗免疫疗法可能会在一小部分患者中引发治愈。此外,在大多数试验中,患者接受化疗至少8-12个周期或永久化疗,而在我们的研究中,患者仅接受6个化疗周期。就副作用而言,短疗程的化疗可能是有益的,因为它缩短了暴露时间,并结合了无化疗间隔。因此,在我们的研究中观察到的3/4级副作用中有90%发生在非化疗期间。
MSS CRC占所有转移性CRC的95%,与MSI CRC33相比,其特点是低TMB和低免疫浸润。此外,KRAS突变与CRC中CD8 T浸润和HLA表达减少有关,因此,KRAS突变的肿瘤细胞被T细胞识别的机会较低34。
两项临床试验(REGOMUNE和REGONIVO)表明,免疫检查点抑制剂可能对MSS肿瘤患者有一些疗效,特别是在没有肝转移的情况下,肝转移是一种免疫抵抗因素35,36,37。在三线MSS结直肠癌中,抗ctla -4和抗pd1 (botensilimab + balstilimab)联合使用也观察到类似的结果,显示出有效的迹象,但肝转移对抗pd -1 +抗ctla -4的疗效有不利影响38。肝转移被怀疑是检查点抑制剂耐药的一般危险因素,因为肝内巨噬细胞消除了抗肿瘤T细胞39。与之前的报道相反,我们的数据支持化疗免疫治疗对MSS CRC的有效性,无论临床特征如何,特别是肝转移的存在。我们的数据与先前的文献一致,表明CD3和CD8 T细胞在结直肠癌侵袭性边缘和肝转移灶中的积累与预后有关40,41,42,43,44,45。
我们的研究强调CTLA-4在肿瘤部位的表达与更好的应答相关。先前的报道在三线CRC38、46、47中测试博tensilimab + balstilimumab或durvalumab + tremelimumab或放疗+ nivolumab和ipilimumab,表明与单独抗pd -1/PD-L1相比,有一定程度的疗效。我们的数据强化了这些发现,并为这项临床观察提供了理论依据。
转录组学分析显示,高免疫浸润,加上高CD8和高PD-L1的结合,与我们的研究结果相关。这些发现反映了GONO组在AtezoTRIBE中观察到的高免疫评分患者从atezolizumab联合FOLFOXIRI48中获益。我们观察到,除了免疫特征外,低iCAFs和低decorin水平与更好的应答相关。先前的一项研究报道了一组MSS黏液性肿瘤对免疫治疗有应答,这表明CRC表型与对免疫检查点抑制剂的应答之间存在联系。iCAF和decorin与预后不良有关,通过成像细胞术,反应不良者胶原蛋白表达高,这可能代表T细胞和肿瘤细胞之间的屏障。这些数据支持这样的假设,即基线免疫浸润和成纤维细胞反应的分析在预测化学免疫治疗的疗效方面可能是重要的。
NY-ESO1和端粒酶免疫应答先前在结直肠癌中有报道,在24%的端粒酶50、51%和20%的NY-ESO1患者中检测到自发应答,与我们的研究结果一致。在接受FOLFOX单药治疗的患者中,在这些研究中没有报道针对共享抗原的特异性T细胞反应的诱导。相反,在我们的试验中,我们观察到化疗免疫治疗后诱导NY-ESO1和端粒酶肿瘤特异性免疫反应。此外,尽管对共享抗原的基线应答与结果无关,端粒酶或NY-ESO1免疫应答的诱导与化学免疫治疗的疗效相关。除了对共同抗原的反应外,我们观察到化学免疫疗法引发了对肿瘤新抗原的外周T细胞反应。综上所述,这些数据支持了化学免疫治疗可以促进MSS转移性结直肠癌中针对共同肿瘤抗原和新抗原的免疫反应,并且这种免疫反应与治疗反应相关的理论基础。最后,对长期应答患者的单细胞和基因组分析表明,除了产生针对共同新抗原的T细胞应答外,这种化学免疫治疗方案还在肿瘤部位和外周诱导和扩增肿瘤特异性新肽免疫应答。
这项研究受到样本量小和缺乏FOLFOX单药治疗对照组的限制。然而,临床数据与先前的双药化疗试验相比是有利的。由于缺乏对照组和小样本量,基因组和转录组数据必须作为探索性的,我们的结果的预测性和预后性需要在更大的随机试验中得到证实。由于缺乏不使用奥沙利铂的对照组,免疫原性细胞死亡的作用尚未得到直接证实。
总之,我们报告了一线化疗免疫治疗不可切除的MSS转移性结直肠癌的良好临床疗效,并进行了深入的分子和免疫分析,为更好地选择MSS转移性结直肠癌患者进行化疗免疫治疗提供了线索,具有潜在的广泛临床意义。
“Durvalumab + Tremelimumab联合FOLFOX治疗mCRC (MEDITREME)的安全性和耐受性评估”试验已在ClinicalTrials.gov注册号NCT03202758 (EudraCT: 2016-005006-19)进行前瞻性注册。
该议定书于2017年3月27日获得了伦理委员会CPP TOURS - r
中心-西部1的批准,编号为2017T1-03,并在法国国家保健品局(ANSM)注册。法国伦理当局要求我们只纳入RAS突变的转移性CRC,因为RAS WT患者必须在一线治疗中接受抗egfr,并且为这些患者提供不含抗egfr的方案是不道德的。该研究是根据赫尔辛基宣言和良好临床实践指南国际统一会议以及ConSORT 2010指南进行的。所有患者在入组前都提供了书面知情同意书。这项研究方案以前在其他地方发表过。最新版本的协议可作为补充信息。
患者在法国的8家医院登记(第戎UNICANCER的乔治-弗朗索瓦勒克莱尔抗癌中心;H?pital Franco-Britannique - foundation Cognacq-Jay, Levallois-Perret;楚,南特;楚,贝桑松;Clinique CARIO, plemizrin;巴黎圣安托万医院;波尔多Bergonie研究所;巴黎蓬皮杜医院)。
完整的纳入和排除标准如下。
入选标准
1.
在执行任何方案相关程序(包括筛选评估)之前,从患者处获得书面知情同意和任何当地要求的授权
2.
入组时年龄≥18岁的男性或女性
3.
根据东方肿瘤合作组织和世界卫生组织的绩效状况为0或1
4.
KRas或NRas突变阳性的结直肠癌组织学确诊诊断
5.
转移性疾病患者
6.
一线转移性疾病或局部治愈性治疗后的一线疾病,伴或不伴FOLFOX辅助化疗。最后一次辅助化疗后复发应≥6个月。以前的围手术期化疗不能用于可切除的转移。
7.
预期寿命超过12周
8.
器官和骨髓功能正常,定义如下:
血红蛋白> 9.0 g dl?1
绝对中性粒细胞计数(ANC) > 1.5 × 109 / L (>1,500 / mm3)
血小板计数> 100 × 109 / L(≥100,000 / mm3)
血清胆红素≤1.5×常规上限(ULN)
AST (SGOT)/ALT (SGPT)≤机构ULN的2.5倍,除非存在肝转移,在这种情况下必须≤5倍ULN
PAL≤5倍机构ULN,除非存在肝转移,在这种情况下必须≤20倍ULN
白蛋白> 30 g L?1
肌酐< 1.5×机构ULN
用Cockcroft - Gault公式(Cockcroft and Gault, 1976)测定血清肌酐CL > 40 ml min - 1或收集24小时尿液测定肌酐清除率:
男性
女性
肌酐CL (ml min?1)
体重(kg) ×(140岁)。72 ×血清肌酐(mg dl?1)
体重(kg) ×(140岁)× 0.85
72 ×血清肌酐(mg dl?1)
9.
肿瘤评估(计算机断层扫描(CT)扫描)在过去4周内至少存在一个可测量的病变,根据RECIST版本1.1
10.
自最后一次化疗、免疫治疗或其他药物治疗和/或放疗后至少4周
11.
根据美国国家癌症研究所不良事件通用术语标准(NCI-CTCAE) 4.0版,先前治疗引起的任何AE恢复至≤1级
12.
对于主要研究:愿意同意使用存档的组织,并提供足够的材料用于分析。辅助研究:活检应能发现转移灶。
13.
女性患者必须具有非生殖潜能(即绝经后:年龄≥60岁,无其他医学原因无月经≥1年,或有子宫切除术史,或有双侧输卵管结扎史,或有双侧卵巢切除术史),或在入组时血清妊娠试验呈阴性
14.
病人必须加入社会保障体系
15.
患者愿意并能够在研究期间遵守协议,包括接受治疗和预定的访问和检查,包括随访
排除标准
1.
参与研究的规划和/或实施(适用于阿斯利康员工和/或研究现场的工作人员)。本研究既往入组者。
2.
在过去4周内参与了另一项临床研究
3.
既往任何PD-1或PD-L1/CTLA-4抑制剂治疗,包括durvalumab或tremelimumab
4.
5年内有其他恶性肿瘤病史,复发风险低,但不包括:
充分治疗的非黑色素瘤皮肤癌或无疾病证据的恶性黄斑
充分治疗无疾病证据的原位癌(例如原位宫颈癌)
5.
在第一次给药前28天接受最后一次抗癌治疗(化疗、免疫治疗、内分泌治疗、靶向治疗、生物治疗、肿瘤栓塞、单克隆抗体、其他研究药物)(对于先前接受过酪氨酸激酶抑制剂(TKIs)(如厄洛替尼、亚硝基脲或丝裂霉素c在6周内(如果由于药物的时间表或药代动力学特性而没有发生足够的洗脱时间,则可能需要更长的洗脱期)。
6.
经Frediricia校正的三张心电图(ECGs)计算的心率(QTc)≥470 ms校正后的平均QT间期
7.
目前或以前在首次给药durvalumab前28天内使用免疫抑制药物,鼻内和吸入皮质类固醇或全身皮质类固醇生理剂量除外,泼尼松或等效皮质类固醇不超过每天10mg
8.
对durvalumab或tremelimumab、FOLFOX或其辅料有过敏史
9.
先前抗癌治疗中未解决的毒性(CTCAE分级>1)。具有不可逆毒性且合理预期不会因试验产品加重的患者可能包括在内(例如,听力损失和周围神经病变)。
10.
既往接受任何免疫治疗药物时发生的≥3级免疫相关不良事件(irAE)或未解决的>1级irAE
11.
过去2年内有活动性或既往记录的自身免疫性疾病。注:不需要全身治疗的白癜风、格雷夫氏病或牛皮癣患者(过去2年内)不被排除在外。
12.
活动性或既往记录的炎症性肠病(例如,克罗恩病和溃疡性结肠炎)
13.
原发性免疫缺陷史
14.
需要使用免疫抑制剂的器官移植史
15.
异体器官移植史
16.
无法控制的并发疾病,包括但不限于持续或活动性感染。临床有明显心血管疾病,包括6个月内心肌梗死;有症状的充血性心力衰竭;不受控制的高血压;不稳定型心绞痛;心律失常;莫比兹II型二度或三度心脏传导阻滞史,无永久性起搏器;低血压;休息肢体跛行或缺血6个月内;活动性消化性溃疡或胃炎;活动性出血性糖尿病,包括任何已知有急性或慢性乙型肝炎、丙型肝炎或艾滋病毒证据的患者;或精神疾病/社会状况会限制患者遵守研究要求或损害患者给予书面知情同意的能力。
17.
严重的并发疾病或合并症,根据研究者的判断,将使患者不适合入组
18.
持续服用CYP3A4底物或定期服用葡萄柚汁
19.
有活动性肺结核病史
20.
脑膜轻脑膜癌病史
21.
脑转移或脊髓压迫
22.
在进入研究前30天内或接受durvalumab后30天内接受减毒活疫苗接种
23.
怀孕或哺乳的女性患者或有生育潜力但未采取有效避孕措施的男性或女性患者
24.
研究者认为会干扰对研究治疗的评价或对患者安全性或研究结果的解释的任何情况
25.
有症状或不受控制的脑转移需要同时治疗,包括但不限于手术、放疗和/或皮质类固醇
26.
癫痫发作失控的患者
27.
受监护、监护或司法保护的患者
28.
已知对研究产品或任何赋形剂过敏或过敏
29.
肿瘤侵犯大血管的患者,影像学检查明确显示
30.
影像学检查明确显示,中心性肺转移灶(即距肺门2厘米内)呈空洞状
31.
既往有与当前结直肠癌相关的出血史的患者
32.
入组前≤3个月有大咯血史(每次咳嗽有半茶匙或更多鲜红色血液)的患者
33.
患者在辅助化疗后复发延迟不到6个月
34.
可切除疾病患者
这是一项多中心、单臂、开放标签、1/2期研究。研究分两个步骤进行(扩展数据图1a)。第1步的主要目的是确定durvalumab(抗pd - l1) + tremelimumab(抗ctla -4) + mFOLFOX6联合治疗的安全性。在首次给药durvalumab + tremelimumab + mFOLFOX6后的两个周期(30 d)内对前9名患者的毒性进行评估。毒性被定义为可能与某一研究药物有关的AE。
第2步的主要目的是确定durvalumab(抗pd - l1) + tremelimumab(抗ctla -4) + mFOLFOX6联合治疗结直肠癌MSS患者PFS的疗效。次要目标是:
确定durvalumab(抗pdl1) + tremelimumab(抗ctla -4) + mFOLFOX6联合治疗在结直肠癌MSS患者的治疗反应和OS方面的疗效。
确定durvalumab(抗pd - l1) + tremelimumab(抗ctla -4) + mFOLFOX6在结直肠癌MSI患者的PFS、治疗反应和OS方面的疗效。
使用PASSV13 (NCSS统计软件)进行样本量计算,使用以下零假设和备选假设作为第2步的主要目标:H0: 3个月时PFS的50%;H1: 3个月时PFS为70.7%(相当于6个月时PFS的50%)。根据Simon的设计,α=10%和β=10%(90%功率),需要43例MSS疾病患者进行主要终点分析。占不可评估患者的20%,52例MSS患者将被纳入。在这52例患者中,前9例患者用于安全性人群分析。MSS患病率约为90-95%,将再纳入5例患者,使整个研究纳入57例患者。
患者接受mFOLFOX6的一线诱导,包括静脉输注85 mg m?2奥沙利铂53和200 mg m?2亚叶酸53,随后静脉注射400 mg m?2 5-FU,随后静脉输注2,400 mg m?2 5-FU,持续46小时。给予6个周期的FOLFOX。在此期间,患者每2周通过静脉输注750mg durvalumab,每周期最多8个剂量;每4周通过静脉输注75mg tremelimumab,每周期最多4个剂量,然后从第16周开始每2周继续750mg durvalumab,长达8个月(18个剂量)。化疗前注射免疫疗法。重新引入mFOLFOX6 durvalumab和tremelimumab是在durvalumab治疗病情稳定超过6个月后由研究者决定的。
临床数据由乔治-弗朗索瓦勒克莱尔中心的统计部门收集。肿瘤评估基于研究者报告的测量结果,并根据RECIST 1.1版进行,每12周重复一次。在整个研究过程中对安全性进行了持续监测。所有ae均按照CTCAE 4.0版本进行记录和分类,无论与研究药物的关系如何。一个独立的安全监测委员会定期审查研究的安全数据。
在基线和第3周、第9周和第23周,外周血样本在10毫升细胞制备管(BD Biosciences)中收集。所有样品在采集后4-6小时内处理。
用于分离PBMCs的血液样本在参与的临床站点进行纵向采集,夜间运输,并在Ficoll梯度上的中心站点(在besanon的生物监测平台上)进行处理,并冷冻保存。血清在每个地点采集后2小时内处理,并立即在- 80°C冷冻,然后分批运送到中央生物库。在筛选期间、第1周期第1天和第15天、第3周期第1天和第6周期第15天以及停止治疗时进行免疫生物标志物的血液采样。这些样本被连夜运送,并在中心地点(第戎的癌症生物学转移平台)进行处理。如果患者在治疗结束前开始任何新的抗癌治疗,则不收集样本。收集基线或档案以及治疗后肿瘤标本进行生物标志物分析。新鲜肿瘤活检立即进行福尔马林固定和石蜡包埋(FFPE)。对于同意的患者,可以进行治疗中活检(在第3周期),也可以进行FFPE。对于病情长期稳定的患者,允许进行额外的活组织检查,定义为连续两次以上的疾病评估显示RECIST 1.1版本的反应以及疾病进展。经医疗监督员批准,允许临时活检采集。
在上述不同时间完成血样后,使用肝素管分离和储存血浆。为此,收集后的肝素管在室温下1000g离心10分钟。然后回收等离子体,以500μl /个冷冻管的速率引用,并在- 80°C保存直至使用。
EDTA管采血后,用SepMate管(85460,STEMCELL Technologies)进行密度梯度离心(Lymphocyte Separation Medium, CMSMSL0101, Eurobio)从全血中分离pbmc。将全血以每管17 ml全血的速率转入SepMate管中,1200 g离心10 min,加速度5,关闭刹车。在尽可能多地去除血浆后,可以回收含有富集pbmc的相。用45 ml PBS洗涤后,300g离心7 min,将PBMC颗粒重悬于5 ml PBS 1x中计数。冷冻保存前,用10ml PBS(1倍)进行最后一次洗涤。冷冻保存包括在50% FBS, 40% RPMI和10% DMSO的溶液中以每根冷冻管8.106个细胞的速率冷冻,直到进一步使用。
在患者治疗前或治疗期间,我们对每个血液样本进行流式细胞术免疫分型。
血细胞计数分析
用于血细胞计数分析的抗体:采用Beckman Coulter定制设计服务及其干涂技术进行多色流式细胞术,制作含有抗cd16 - fitc(克隆3G8)、抗cd56 - pe(克隆N901)、抗cd19 - pe - cy5.5(克隆J3-119)、抗cd14 - pe - cy7(克隆RMO52)、抗cd4 - apc(克隆13B8.2)、抗cd8 - alexa Fluor 700(克隆B9.11)、抗cd3 - apc - alexa Fluor 750(克隆UCTH1)、抗cd15 - pacificblue(克隆80H5)和抗cd45 - kromeorange(克隆J.33)的定制管。
染色方案:取100 μl肝素化总血加入DURAClone管中,立即旋涡15s,室温黑暗孵育15min。加入含50 μl固定剂IOTest 3固定液(A07800, Beckman Coulter)的红血溶解液(VersaLyse solution, A09777, Beckman Coulter) 2毫升,倒置暗处孵育15分钟。然后,在Canto II细胞仪(BD Biosciences)上采集前加入100μl计数珠(Flow-Count Fluorospheres, 7547053, Beckman Coulter)。
免疫细胞群鉴定
为了破译外周免疫系统,我们进行了五个小组来识别和表征不同的淋巴细胞和骨髓亚群。
T细胞分析抗体(第一张图):利用贝克曼库尔特公司定制设计服务及其干涂技术,制作了含有抗cd183 - fitc(克隆G025H7)、抗cd197 - pe(克隆G043H7)、抗cd196 - pe - cy7(克隆B-R35)、抗cd278 - apc(克隆ISA-3)、抗cd45ra - alexa Fluor 700(克隆2H4LDH11LDB9 (2H4))、抗hla - dr - apc - alexa Fluor 750(克隆immune -357)、抗cd4 - pacificblue(克隆13B8.2)和抗cd8 - kromeorange(克隆B9.11)的定制管。液体抗体:抗ccr4 - percp - cy5.5 (BioLegend,克隆L291H4)和抗cd28 - bv605 (BD Biosciences,克隆CD28.2)。
T细胞分析抗体(第二图):采用贝克曼库尔特定制设计服务及其干涂技术,生产定制管,包含抗cd183 - fitc(克隆G025H7)、抗cd197 - pe(克隆G043H7)、抗cd196 - pe - cy7(克隆B-R35)、抗pd1 - apc(克隆PD1.3)、抗cd45ra - alexa Fluor 700(克隆2H4LDH11LDB9 (2H4))、抗cd4 - pacificblue(克隆13B8.2)和抗hla - dr - kromeorange(克隆immune -357)。还使用液体抗体:抗cd80 - apc - alexa Fluor 750 (BD Biosciences,克隆L307.4)和抗cd127 - bv605 (BioLegend,克隆A019D5)。
Treg细胞分析用抗体:利用Beckman Coulter公司定制设计服务及其干包膜技术,制作了含有抗cd25 - pe(克隆B1.49.9)、抗cd39 - pe - cy5(克隆BA54)、抗pd1 - pe - cy7(克隆PD1.3)、抗cd275 - apc(克隆ISA-3)、抗cd45ra - alexa Fluor 700(克隆2H4LDH11LDB9 (2H4))、抗cd4 - pacificblue(克隆13B8.2)和抗cd8 - kromeorange(克隆B9.11)的定制管。液体抗体:抗ccr4 - percp - cy5.5 (biolgend,克隆L291H4),抗cd80 - apc - alexa Fluor 750 (BD Biosciences,克隆L307.4)和抗tim3 - bv605 (biolgend,克隆F38-282)。
自然杀伤(NK)细胞分析抗体:利用Beckman Coulter的定制设计服务及其干涂技术,生产了含有抗cd159a - pe(克隆Z199)、抗pd1 - pe - cy5(克隆PD1.3)、抗cd335 - pe - cy7(克隆BAB281)、抗cd314 - apc(克隆ON72)、抗cd56 - apc - alexa Fluor 750(克隆N901)、抗cd16 - pacblue(克隆3G8)和抗cd45 - kromeorange(克隆J33)的定制管。液体抗体:抗tim3 - fitc (Miltenyi Biotec,克隆REA635),抗nkg2c - alexa Fluor 700 (R&D Systems,克隆134591)和抗cd3 - bv605 (BioLegend,克隆UCHT1)。
用于骨髓细胞分析的抗体:采用Beckman Coulter定制设计服务及其干涂技术进行多色流式细胞术,定制管含有抗cd33 - fitc(克隆D3HL60.251)、抗cd39 - pe(克隆BA54)、抗cd3 - pe - cy5(克隆UCTH1)、抗cd19 - pe - cy5(克隆J3-119)、抗cd20 - pe - cy5(克隆B9E9)、抗cd56 - pe - cy5(克隆N901)、抗pd - l1 - apc(克隆PDL1.3.1)、抗hla - dr - apc - alexa Fluor 750(克隆immune -357)、抗cd15 - pacificblue(克隆80H5)、产生了抗cd14 - kromeorange(克隆RMO52)和死亡标记物DRAQ7。将以下液体抗体添加到定制管中:anti-CD11b-BV605 (BioLegend,克隆ICRF44)。
染色方案:每个含有抗体液的DURAClone管中加入100 μl总肝素化血,立即旋流式15s,室温黑暗孵育15min。加入含50 μl固定剂IOTest 3固定液(A07800, Beckman Coulter)的红血溶解液(VersaLyse solution, A09777, Beckman Coulter) 2毫升,倒置暗处孵育15分钟。离心后用3ml PBS 1x洗涤,用150μl PBS 1x重悬细胞,然后在Canto II细胞仪(BD Biosciences)上采集。
淋巴细胞功能分析
利用贝克曼库尔特的定制设计服务及其干涂技术,生产了含有抗ifn -γ-FITC(克隆45.15)、抗cd25 - pe(克隆B1.49.9)、抗cd4 - pe - cy5.5(克隆13B8.2)、抗il -4- pe - cy7(克隆MP4-25D2)、抗foxp3 - alexa Fluor 647(克隆259D)、抗tnf -α-Alexa Fluor 700(克隆IPM2)、抗cd3 - apc - alexa Fluor 750(克隆UCHT1)、抗il - 17a - pacificblue(克隆BL168)和抗cd8 - kromeorange(克隆B9.11)的定制管。同时采用液体抗体:抗il -2- bv605 (BioLegend,克隆MQ1-17H12)。
染色方法:取100 μl总肝素化血加入DURActive 1管,其中含有磷酸肉豆酸酯、离子霉素和brefledin a (C11101, Beckman Coulter), 37℃,黑暗条件下保存3 h。活化后,在旋涡上加入25 μl的PerFix-NC R1缓冲液(PerFix-NC Kit, B31168, Beckman Coulter),室温孵育15 min。然后加入2 ml PBS (1×),离心后用25 μl FBS (Dutscher)重悬,加入300 μl PerFix-NC R2缓冲液。将325 μl的等分液转移到含有抗体液体的DURAClone管中,立即旋转15s,室温下黑暗孵育1h。在试管中加入PBS 1× (3ml),室温黑暗孵育5min, 500g离心5min。去除上清后,将细胞重悬于3ml的1x PerFix-NC R3缓冲液中,然后500g离心5分钟。将颗粒干燥后用150 μl的1× R3缓冲液重悬。采集是在Canto II细胞仪(BD Biosciences)上完成的。
获取后,在Kaluza分析软件(Beckman Coulter)上对每个。fcs文件进行补偿验证,然后进行无监督分析。
病理学家对FFPE肿瘤标本中的肿瘤细胞含量进行评估后,对标本进行宏观解剖,使肿瘤细胞含量达到80%以上,进行核酸提取。使用Maxwell 16 FFPE Plus LEV DNA纯化试剂盒(Promega)从肿瘤组织中分离DNA。按照制造商的说明,使用Maxwell 16血液DNA纯化试剂盒(Promega)从全血(种系DNA)中分离DNA。提取的基因组DNA的数量通过荧光法与量子比特装置进行评估。根据制造商的协议,使用Maxwell RSC RNA FFPE Kit (Promega)提取RNA。采用分光光度法测定DNA和RNA的质量和数量,吸光度分别为230 nm、260 nm和280 nm。肿瘤纯度报告在每个外显子组和RNA-seq数据的表格中,其中信息可用(补充文件表7)。
使用Agilent SureSelectXT试剂盒,200纳克基因组DNA用于文库制备。整个富集文库用于杂交,并使用SureSelect All Exon v5或v6 (Agilent)诱饵捕获。杂交后,根据制造商的建议纯化捕获的文库,并通过聚合酶链反应扩增(12个循环)。归一化文库汇集,在Illumina NextSeq 500设备上使用2× 111碱基对(bp)配对的末端读取和多路复用进行DNA测序。
使用NEBNext Ultra II RNA定向文库准备试剂盒(NEBNext Ultra II RNA定向文库准备试剂盒for Illumina),根据制造商的说明(New England Biolabs),使用核糖体RNA的RNA进行文库准备。RNA-seq在NextSeq 500设备(Illumina)上进行。测序结果为76 bp对端reads。
这项分析是在一名完全缓解的患者身上进行的。本例患者手术当天采集新鲜肿瘤组织。根据制造商的说明(130-095-929,Miltenyi Biotec),使用人肿瘤解离试剂盒机械和酶解肿瘤。简而言之,肿瘤被切成小块,转移到含有酶混合物的绅士macs C管中。解离采用带加热器的gentleMACS Octo解离器和人肿瘤解离37C_h_TDK_1程序进行。样品均质后,应用于MACS SmartStrainer 70μM (130-110-916, Miltenyi Biotec),并置于50 ml管中。用20 ml无血清RPMI (L0500-500, Dutscher)洗涤滤网,300g离心7分钟。上清完全抽吸后,肿瘤细胞悬液在RPMI中重悬,用台盼蓝计数,去除死细胞。将细胞冷冻在50%胎牛血清(Dutscher)、40% RPMI和10% DMSO (P60-36720100, Dutscher)的溶液中,待进一步使用。我们还收集了该患者在不同时间点的pbmc:在第1周期,第5周期和手术时;如上所述分离pbmc并冷冻。在单细胞实验当天,样品首先进行特定的制备程序。简而言之,根据基于级联稀释的10x Genomics解冻方案,对样品进行解冻。然后根据制造商的说明书(130-090-101,Miltenyi Biotec),用死细胞去除试剂盒去除死细胞。CD3 MicroBeads (130-050-101, Miltenyi Biotec)标记后,在磁柱上分离每个样品的CD3 T细胞。为了更好地纯化CD3 T细胞,我们用抗tcr αβ- pe(克隆IP26A, Beckman Coulter)和抗tcr γδ(克隆IMMU510, Beckman Coulter)标记样品,用Aria Fusion Sorter对这两种标记之一的阳性细胞进行分选。最后,我们以每微升1000个细胞重悬细胞,然后根据制造商的说明使用Chromium设备(10x Genomics)进行细胞包封步骤。
文库制备采用5 ' mRNA文库制备和VDJ (10x Genomics)。测序在Illumina HiSeq 4000设备上进行。文库以100 bp对端reads测序。
在研究开始前(档案材料)、基线时或治疗期间收集活检,收集后由病理实验室用多聚甲醛固定并包埋石蜡。从FFPE肿瘤样本上切下4微米的切片。石蜡包埋的组织在徕卡旋转切片机(RM2145)上切割。对于CD8和PD-L1染色,将载玻片去蜡并使用PT连接(Agilent)和Autostainer 48 (Agilent)进行染色。简而言之,用pH 9的缓冲液在95°C下分离25分钟。冷却后,载玻片在洗涤缓冲液(Agilent)中洗涤两次,洗涤5分钟。使用过氧酶阻断试剂(SM801, Agilent)进行过氧酶阻断。然后,在室温下加入抗人CD8(1:100,克隆C8/144B, M7103, Agilent)或抗人PD-L1(1/200,克隆QR1, C-P0001-01, Diagomics) 30min。两步洗涤后,在室温下加入EnVision FLEX HRP聚合物(SM802, Agilent) 15分钟。然后将DAB (SM803, Agilent)加入样品中2分钟。经过两个新的洗涤步骤后,载玻片最后用苏木精(SM806, Agilent)孵育20分钟,并使用徕卡自动盖片器永久安装。对于双重染色程序,抗原提取后,按照前面的描述,抗decorin抗体(1:100,克隆E2N2C, 85786, CST)加入30分钟,扩增步骤按照前面的描述,HRP Magenta (GV92511-2, Agilent)加入5分钟。然后用剥离液54洗脱抗体。然后将抗satb2抗体(1:100,克隆EP281, BSB-3202, Diagomics)应用于组织切片30分钟。扩增步骤,反染色步骤和安装程序,然后进行前面所述。染色后永久裱片,使用NanoZoomer HT2.0 (Hamamatsu)以×20放大倍数对载玻片进行数字化处理,生成。ndpi格式的整片成像(WSI)文件。使用QuPath软件(版本2)55,对肿瘤核心的三个区域和切片的三个侵犯前沿区域进行CD8和PD-L1分析,并由病理学家验证注释。CD8分析,计算每个区域的阳性细胞数,并计算平均值。对于PD-L1分析,根据二氨基联苯胺强度(棕色染色)确定每个子集的截止值,并自动应用于注释区域(即阴性,1+,2+和3+)检测到的每个细胞。计算PD-L1 H-score: H-score=[1 × (% cells 1+) + 2 × (% cells 2+) + 3 × (% cells 3+)]56。对于decorin/SATB2双染色,由病理学专家对decorin强度进行定量评估,分为阴性、低和高三类。
抗体和我tal接合
根据制造商的说明(PRD002 Rev 14, Fluidigm, Standard BioTools),使用Maxpar X8抗体标记试剂盒将非Standard BioTools提供的抗体偶联到纯化的镧系金属上,并在抗体稳定剂缓冲液(CANDOR Bioscience)中洗脱。使用先前研究中描述的程序,用89Y金属标记CD15。本小组使用的抗体以及有关克隆、供应商、标签和稀释的信息详见补充文件表8。
抗体染色
使用pH为9的Dako Target retrieval Solution (S236784-2, Agilent)在水浴(96°C, 30分钟)中进行脱蜡和抗原回收后,用Dako Pen将3μm组织切片圈起来,用SuperBlock (37515, Thermo Fisher Scientific)在室温下孵育45分钟,然后用FcR Blocking Reagent (130-092-575, Miltenyi)在室温下孵育1小时(1:100,PBS/1% BSA缓冲液)。在PBS/0.2% Triton X-100 (PBS- t)中洗涤三次(每次8分钟)后,将PD-L1抗体稀释在PBS/1% BSA缓冲液中,在4℃下孵育过夜。第二天,载玻片在PBS- t中洗涤3次(每次8分钟),将二抗兔抗体(3175002G, Standard BioTools)在PBS/1% BSA缓冲液中按1:500稀释,室温孵育2小时。在PBS- t中洗涤三次(每次8分钟)后,金属标记抗体(列表见补充文件表8)在PBS/1% BSA缓冲液中稀释。一抗在4°C孵育过夜后,切片在PBS- t中洗涤三次(每次8分钟),细胞核用DNA插层器铱(1:400 PBS, Fluidigm, Standard BioTools)在室温下染色30分钟。切片在PBS中洗涤5英里,然后在蒸馏水中洗涤5分钟,然后在室温下干燥30分钟。
数据采集
根据制造商的说明,使用Hyperion成像系统(Fluidigm, Standard BioTools)获取图像。在切片中选择感兴趣区域(ROI)后,用200 Hz的紫外激光对ROI进行消融。数据导出为。MCD文件,并使用Fluidigm MCD查看器1.0.560.6进行可视化。最小和最大阈值适用于每个标记物和每个组织,以获得最佳可视化。Gamma被设置为1。
成像质量细胞术数据预处理和细胞分割
原始数据(。使用Steinbock管道(版本0.15.0)处理mcd文件58。简而言之,使用基于机器学习的Mesmer算法(Steinbock工具包)进行自动像素分类,使用DeepCell库进行细胞分割59。简而言之,我们将.mcd文件转换为.tiff文件,并在其上应用了50的热像素过滤器。为了生成分割掩模,我们使用DNA作为核标记,使用pank、CD163、CD11b、CD45RO、CD31、CD66b、CD11c、CD4、CD68、CD45RA、CD8、CD45、GrB、Ki-67、Zeb-1、CasP3、Tim3和HLA-DR作为膜/细胞质标记,默认设置为(像素大小为1μm,全细胞分割,不归一化,平均聚集)。然后,我们生成了第二组单独的。tiff文件,使用R包EBImage60的computeFeatures函数提取每个单元的每个标记的平均信号强度,并使用R包flowCore61编译成。fcs单细胞文件。
使用Human XL Cytokine Magnetic 45-plex Luminex Assay (898855, R&D Systems),根据生产商说明,对血浆中的45种分析物进行定量:C-C基序趋化因子配体2 (CCL2)、CCL3、CCL4、CCL5、CCL11、CCL19、CCL20、CD40配体、fractalkine、C-X-C基序趋化因子配体1 (CXCL1)、CXCL2、CXCL10、表皮生长因子(EGF)、成纤维细胞生长因子(FGF)、fms样酪氨酸激酶3配体(FLT3L)、粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、颗粒酶B、IFN-α、IFN-β、IFN-γ、IL-1α、IL-1β、IL-1RA、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12、IL-13、IL-15、IL-17A、IL-17E、IL-33、程序性死亡配体1 (PDL1)、血小板源性生长因子(PDGF)-AA、PDGF- ab /BB、转化生长因子(TGF)-α、肿瘤坏死因子(TNF)-α、TNF相关凋亡诱导配体(TRAIL)和血管内皮生长因子(VEGF)。每种分析物的性能测定标准值详细见扩展数据表2。
用8种TERT衍生的MHC ii类结合肽(HLA-DR和hla - dp限制性TERT肽池62,63)和5 μg ml - 1 NY-ESO1肽混合物短期体外刺激PBMCs后,用IFN-γ ELISpot评估循环肿瘤特异性T细胞的反应62,64。所有合成肽(纯度>90%)均购自JPT。从流感病毒、爱泼斯坦-巴尔病毒和巨细胞病毒(细胞技术)中提取的多肽混合物(CEF)用于评估抗病毒药物的召回反应。简而言之,将冷冻的pbmc解冻,用肿瘤来源的肽(5μg ml?1)培养。用RPMI 5%人血清培养24孔板(每孔4 × 106个细胞)。在第1天和第3天分别添加IL-7 (5 ng ml?1,200-07,PeproTech)和IL-2 (20 ng ml?1,202-IL-010, Novartis)。在细胞培养的第7天,根据制造商的说明,用IFN-γ ELISpot法检测抗原特异性T细胞的存在。简单地说,体外刺激的淋巴细胞(每孔105个)在预先包被抗人IFN-γ单克隆抗体的ELISpot板上,在X-VIVO 15培养基(BE04-418, Ozyme)中,有或没有肽混合物,在37°C下孵育18小时。分别以12-肉豆酸酯13-乙酸phorbol (1 ng ml?1,P8139, Sigma-Aldrich)/离子霉素(10 mmol L?1,I3909, Sigma-Aldrich)为阴性对照和阳性对照单独培养细胞。IFN-γ斑点按照制造商的说明(Diaclone)显示。在背景值减去(培养基)后,计算每105个细胞中表达为ΔIFN-γ点的特异性T细胞的数量。使用CTL免疫斑点系统(Cellular Technology)对斑点形成细胞进行计数。当IFN-γ斑点数大于10且大于背景数65的两倍时,反应被认为是阳性的。
从患者外显子组分析中鉴定出14个主要在体细胞外显子组表达的新肽(fold change (FC)有利于肿瘤,中位MT 50%抑制浓度(IC50) < 50)后,进行了同样的实验。对于本研究中的10例患者,在按照与前面描述的相同方式选择后,也合成了新肽(根据患者的不同,从1到8个)。所有新肽(纯度>90%)均购自JPT。简而言之,实验的方式与TERT和NYESO1肽相同,在10μg ml?1的新肽池存在或不存在的情况下培养患者的pbmc。
FASTQ格式的Reads使用Burrows-Wheeler比对器(BWA版本0.7.17)与参考人类基因组GRCh37比对。使用Genome Analysis Toolkit (GATK version 4.13.0)进行局部比对。使用Picard 2.5版本删除了重复读取。在匹配肿瘤正常样本的情况下,体细胞单核苷酸变异(snv)通过整合来自三个不同突变调用者的突变调用的有效管道被识别出来。snv是用VarScan(2.4.3版本)66和Mutect(1.1.7版本)67调用的,插入/删除(indel)是用VarScan和Strelka(2.9.2版本)68调用的。仅在肿瘤情况下,使用GATK软件提供的Mutect2(文献69)来调用snv。
TMB的计算方法是使用显著snv的数量(过滤掉未翻译的转录区、同义词、内含子和基因间snv)除以在定义水平上覆盖的百万碱基的数量。为了鉴定肿瘤特异性突变肽,使用pvacs - seq (personalized Variant Antigens by Cancer Sequencing) (pVACtools version 1.5.4)70;pVAC-Seq是基于HLAminer71获得的HLA分型。使用TITAN(1.23.1版本)72和SuperFreq(1.4.2版本)73分别对匹配的肿瘤-正常样本和肿瘤-纯样本进行分析,从全外显子组测序数据中推断拷贝数改变(CNA)亚克隆的数量、大缺失的数量和杂合性损失(LOH) > 15 Mb。它也被用来估计肿瘤的倍性。拷贝数变异(CNV)签名是根据Macintyre等人的方法推断出来的74。基于7个签名的加权组合重建每个患者的拷贝数谱。MSI评分使用MSIsensor75计算。HRD评分通过scarHRD管道76获得。
原始FASTQ数据进行伪对齐,使用Kallisto软件对基因计数和每千碱基百万转录本(TPM)进行量化77。作为参考的Kallisto转录物索引由GRCh37组装体Ensembl中合并的人cDNA和ncDNA文件构建。然后用DESeq2文库创建基因水平计数和转录本矩阵。通过去除reads过少的基因来预先过滤低计数基因。使用DESeq2 R包筛选差异表达基因78。基因集富集分析(GSEA)79使用来自Broad研究所和fgsea R package80的癌症基因集标记对得到的差异基因进行分析。
使用MCP-counter、ImmuCellAI和工具,按照各自的指南,对肿瘤微环境(TME)相关转录组元件进行量化。MCP-counter23方法允许对8个免疫细胞群和2个基质细胞群的绝对丰度进行稳健的定量。ImmuCellAI24通过基于基因集签名的方法估计24种免疫细胞类型的丰度。最后,Kassandra使用树形机器学习算法对组织中不同层次上的细胞比例进行反卷积25。
使用CMScaller81 R包进行一致的分子分型。
使用Cell Ranger(版本3.1.0)进行原始数据预处理。使用Cell Ranger计数将每个文库与索引的hg19基因组对齐。Cell Ranger的输出被加载到R中,并使用Seurat管道(版本3.1.2)进行进一步分析。使用R软件包Seurat (version 3.2.0)82对scRNA-seq数据进行降维、聚类和差异表达分析。表达少于200个或多于2500个基因的细胞以及表达超过10%的线粒体基因的细胞被过滤出分析。对基因表达进行归一化和对数变换。为了比较从第0天的肿瘤、第30天的肿瘤、手术时的血液和TILs中获得的4个数据集,使用锚点将它们整合在一起,锚点被选为数据集中出现频率最高的特征。结果总共有5764个CD8 T细胞(第0天有1724个细胞,第30天有721个细胞,手术时血液中有1313个细胞,TILs中有2006个细胞)。我们确定了每个细胞的20个近邻,构建了共享近邻(SNN)图,并优化了模块化函数来执行聚类算法。将得到的9个聚类以二维t分布随机邻居嵌入(tSNE)83表示进行可视化。用Wilcoxon秩和检验选择簇间差异表达的基因。
为了确定所有细胞簇的分化轨迹,我们使用了R包Monocle 2(参考文献84)。Monocle使用一种算法来了解每个细胞作为动态生物过程(例如分化或再生)的一部分必须经历的基因表达序列的变化。更准确地说,使用DDRTree方法学习树状轨迹,在伪时间中排序,最后在二维空间中可视化。
TCR测序用于计数在每个样本中检测到的两个以上细胞的克隆型。细胞的克隆型定义为该细胞的α链和β链CDR3核苷酸序列的组合。由于不可能推断具有多个beta链的分区的beta链和alpha链配对,因此将这些分区视为单个克隆。为了评估克隆富集,比较每个克隆的不同样品类型具有相同克隆的细胞比例。为了确定CD8 T细胞的克隆扩增是否可能由共同抗原驱动,我们使用GLIP27算法(1.0版本)来评估四个样本中TCR CDR3的相似性和推测的共享特异性。
疗效人群包括所有符合资格标准并接受至少一个完整或两个不完整治疗周期的参与者。所有开始研究治疗的入组患者均纳入安全性分析。
PFS被定义为从转移诊断之日到RECIST首次记录的疾病进展证据、临床评估或死亡的时间。OS计算为从转移诊断日期到死亡日期的时间。中位随访时间采用反Kaplan-Meier法计算,生存终点采用Kaplan-Meier法描述。在最后一次随访时,对存活且无事件的患者的数据进行审查。使用Kaplan-Meier法估计生存概率,使用log-rank检验比较生存曲线。在任何特定时间将分数生存率的95% ci添加到生存曲线中。采用单因素Cox比例风险模型来估计HR和95% CI,以检验不同变量与OS和PFS的相关性。
定量变量用中位数和极差来描述。定性变量用数字、百分比和95% CI(二项律)来描述。估计参数以双侧95% ci报告。P≤0.05认为有统计学意义。采用R软件4.0.3版(http://www.R-project.org/)进行统计分析,图形绘制采用GraphPad Prism 9.0.2版。
计算使用DNUM CCUB (Bourgogne大学计算中心)的高性能计算资源进行。
有关研究设计的更多信息可在本文链接的自然组合报告摘要中获得。
下载原文档:https://link.springer.com/content/pdf/10.1038/s41591-023-02497-z.pdf




